低蛋白质饲粮中添加益生菌对育肥猪生长性能、粪便菌群组成和代谢组特征的影响 | 微生态前沿

摘要:本试验旨在探讨低蛋白质饲粮中添加益生菌对育肥猪生长性能、粪便菌群组成和代谢组特征的影响。选取平均体重为(80.56±0.45)kg的长×大育肥猪90头,随机分为3组,分别为对照组、试验Ⅰ组和试验Ⅱ组,每组3圈(重复),每圈10头(阉公猪与母猪各占1/2)。对照组饲喂含14%蛋白质的常规蛋白质饲粮,试验Ⅰ组饲喂含12%蛋白质的低蛋白质饲粮,试验Ⅱ组饲喂添加益生菌的低蛋白质饲粮(每千克低蛋白质饲粮中含2.0×109CFU乳酸菌和2.0×108CFU酿酒酵母)。预试期5d,正试期42d。结果显示:1)与对照组和试验Ⅰ组相比,试验Ⅱ组的平均日增重显著提高(P<0.05),料重比显著降低(P<0.05)。2)与对照组和试验Ⅱ组相比,试验Ⅰ组粪便中颤螺菌目、毛螺菌目、毛螺菌科、瘤胃球菌科、UCG-005、粪杆菌属、小杆菌属和福涅氏菌属的相对丰度显著降低(P<0.05),解纤维素菌属的相对丰度显著增加(P<0.05);试验Ⅱ组粪便中毛螺菌目、乳杆菌目和毛螺菌科的相对丰度显著高于对照组(P<0.05)。3)试验Ⅰ组与对照组、试验Ⅱ组与对照组以及试验Ⅰ组与试验Ⅱ组粪便样品间分别发现9、37和41种差异代谢物;不同组间差异代谢物的KEGG通路富集分析显示共有27条富集通路;与对照组和试验Ⅰ组相比,试验Ⅱ组粪便中5-羟基吲哚乙酸的表达量显著升高(P<0.05),肾上腺素的表达量显著降低(P<0.05);试验Ⅰ组粪便中N-乙酰-L-苯丙氨酸的表达量显著低于对照组和试验Ⅱ组(P<0.05);试验Ⅱ组粪便中L-谷氨酰胺、D-葡萄糖醛酸的表达量显著高于试验Ⅰ组(P<0.05)。4)与对照组相比,试验Ⅰ组和试验Ⅱ组粪便中总支链脂肪酸、总短链脂肪酸、氨氮和粪臭素含量显著减少(P<0.05);与试验Ⅰ组相比,试验Ⅱ组粪便中乙酸含量显著减少(P<0.05),丁酸含量显著增加(P<0.05)。综上所述,在低蛋白质饲粮中添加益生菌(乳酸菌和酿酒酵母)可改善育肥猪的肠道菌群结构及其代谢物表达,减少粪便中总短链脂肪酸、氨氮和粪臭素含量,提高育肥猪的平均日增重和饲料转化效率。
我国2021年生猪存栏44922.4万头,猪肉产量5295.9万t,猪肉是人们膳食中重要的蛋白质、能量、维生素和矿物质来源。然而,我国蛋白质饲料短缺和氮排放过量等问题制约了养猪业的可持续发展。低蛋白质饲粮和益生菌制剂的研发与应用有望缓解上述问题,具有重要的科学意义和广阔的应用前景。低蛋白质饲粮是将饲粮的蛋白质水平按NRC或我国《猪营养需要量》中的推荐量降低1~4个百分点,并添加适宜种类和数量的氨基酸,从而减少蛋白质原料用量,既能保证猪的生产性能和产品品质,又能降低养殖成本,减少氮的排放。益生菌能够改善猪的肠道菌群结构、促进肠道有益菌增殖以及短链脂肪酸(short chain fatty acids,SCFAs)生成,提高猪的健康水平及生产性能。García等在低蛋白质饲粮中添加益生菌(枯草芽孢杆菌和地衣芽孢杆菌)饲喂断奶仔猪,发现改变了仔猪肠道发酵模式,减少了氨和支链脂肪酸(branched-chain fatty acids,BCFAs)含量,降低了仔猪腹泻率,提高了仔猪生长性能。但到目前为止,在低蛋白质饲粮中补充益生菌对育肥猪生长性能、肠道菌群及代谢组的研究鲜有报道。本研究探讨了低蛋白质饲粮中添加益生菌对育肥猪生长性能、粪便菌群组成和代谢组特征的影响,旨在优化育肥猪饲粮配制,促进生猪产业绿色发展。
1 材料与方法
1.1 试验材料
本试验所用益生菌制剂为北京市农林科学院畜牧兽医研究所动物营养研究室配制,由乳酸菌和酿酒酵母组成,其中乳酸菌(干酪乳杆菌和植物乳杆菌按照1∶1混合)有效活菌数为2×1010CFU/g,酿酒酵母有效活菌数为2×109CFU/g。
选用长×大二元杂交育肥猪90头,平均体重为(80.56±0.45)kg,随机分为3组,分别为对照组、试验Ⅰ组和试验Ⅱ组,每组3圈(重复),每圈10头(阉公猪与母猪各占1/2)。对照组饲喂含14%蛋白质的常规蛋白质饲粮;试验Ⅰ组饲喂含12%蛋白质的低蛋白质饲粮;试验Ⅱ组饲喂添加益生菌的低蛋白质饲粮(每千克低蛋白质饲粮中含乳酸菌2.0×109CFU、酿酒酵母2.0×108CFU)。参照《猪营养需要量》(GB/T39235—2020)配制试验饲粮,在低蛋白质饲粮中补充赖氨酸、蛋氨酸、苏氨酸和色氨酸,使这4种氨基酸的含量在各试验饲粮中保持相近。试验饲粮组成及营养水平见表1。将饲料原料加工成粉料后按照配方设计混匀,添加益生菌时,采用逐级扩大方式,确保其均匀分布在饲粮中,每天配制1次饲粮。
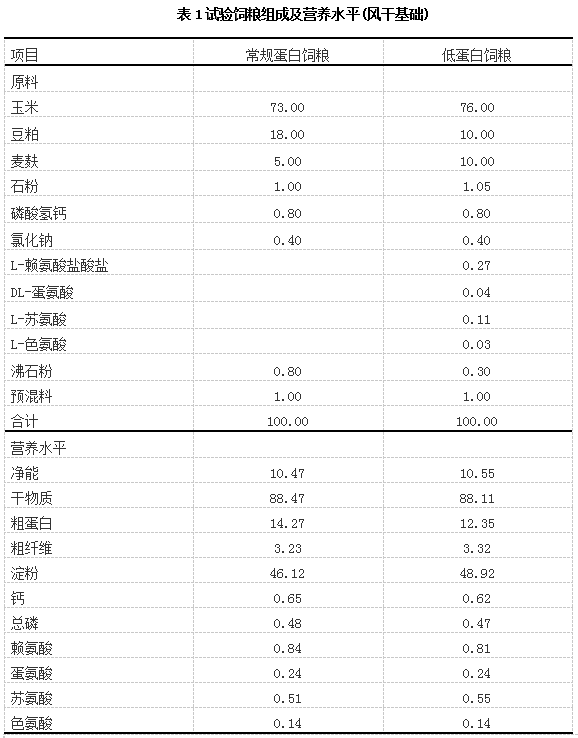
1)预混料为每千克饲粮提供:VD3950IU,VA4500IU,VK30.5mg,VE12mg,VB11.5mg,VB22mg,VB61.0mg,VB120.004mg,泛3mg,烟酸4.8mg,生物素0.5mg,Fe100mg,Mn20mg,Cu6mg,Zn80mg,Se0.3mg,I0.5mg。
2)净能、粗纤维和淀粉为参照GB/T39235—2020所得计算值,干物质、粗蛋白质、钙、总磷和氨基酸为实测值。
试验猪在同一栋猪舍内分圈饲养,自由采食,自由饮水,猪舍内温度在20~28℃,相对湿度在50%~80%,按猪场内统一要求对猪群进行饲养管理,预试期5d,正试期42d。
干物质含量参照GB/T6435—2006、粗蛋白质含量参照GB/T6432—2018、钙含量参照GB/T6436—2018、总磷含量参照GB/T6437—2018、氨基酸含量参照GB/T18246—2019进行测定。
试验开始和结束时,对猪进行空腹称重;在试验期内,试验人员每天按圈记录饲粮的使用情况。试验结束后,计算试验期内猪只的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
试验结束的当天早晨采集粪便样品,每圈采集4头猪的新鲜粪便,分别置于无菌袋中混匀,每2份等量混匀合为1个粪便样品,分装于无菌离心管中,放在干冰中带回实验室-80℃保存,用于粪便菌群分析、代谢组学分析以及吲哚、粪臭素、氨氮和SCFAs含量的测定。试验共采集粪便样品18个
粪便菌群总DNA提取及PCR产物纯化参照文献的方法进行,纯化后样品送至上海美吉生物医药科技有限公司进行微生物测序,菌群分析在美吉生物云平台上完成。
准确称取100mg粪便样品于2mL离心管中,加入1颗直径为6mm的研磨珠和400μL的提取液(提取液由甲醇和水组成,体积比为4∶1,并含0.02mg/mLL-2-氯苯丙氨酸作为内标),制备成样本溶液;样本溶液在-10℃、50Hz的冷冻组织研磨仪(KZ-Ⅲ-FP,武汉赛维尔生物科技公司)中研磨6min,再经30min的5℃、40kHz低温超声提取制成样品;将样品在-20℃下静置30min,然后于4℃、13000×g条件下离心15min,移取上清液至进样小瓶中上机分析。分析仪器为超高效液相色谱串联傅里叶变换质谱系统(UHPLC-QExactiveHF-X,赛默飞公司,美国)。具体分析方法参照文献。
差异代谢物的筛选参照曾成容等和王燕等的方法,依据变量重要性投影(variableimportanceinprojection,VIP)、上/下调差异表达倍数(foldchange,FC)和统计学P值(P-value)进行,当VIP>1、FC>1.2、P<0.05时,认定该代谢物为差异代谢物,使用火山图显示差异代谢物的整体分布情况。基于KEGG数据库对差异代谢物进行通路富集分析,使用Scipyv1.0.0软件检验显著富集的通路(P<0.05)。数据分析在美吉生物云平台上完成。
粪便中吲哚和粪臭素的含量测定参照文献中的方法进行测定;氨氮含量参照《土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定氯化钾溶液提取-分光光度法》(HJ634—2012)中的方法进行测定;SCFAs含量参照文献中的方法进行测定。
试验结果用平均值±标准误表示,利用SPSS19.0软件对数据进行单因素方差分析,并采用Duncan氏法进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 育肥猪的生长性能
由表2可知,饲喂低蛋白质饲粮的试验Ⅰ组与对照组相比,育肥猪的生长性能无显著差异(P>0.05);饲喂添加益生菌低蛋白质饲粮的试验Ⅱ组与对照组和试验Ⅰ组相比,育肥猪的平均日增重显著提高(P<0.05),料重比显著降低(P<0.05)。
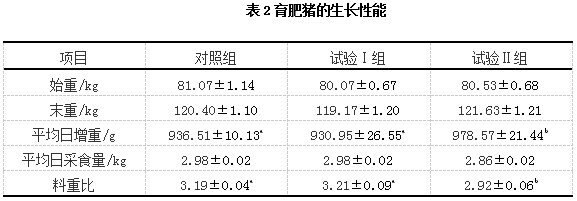
注:同行数据肩标不同小写字母表示差异显著(P<0.05),肩标无字母或相同小写字母表示差异不显著(P>0.05)。下表(表5除外)同。
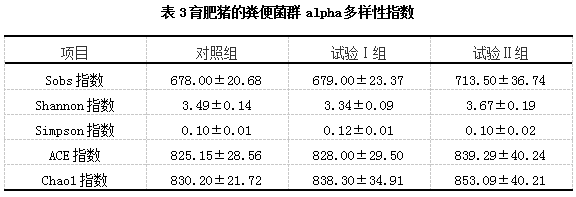
由表3可知,试验Ⅱ组育肥猪粪便菌群的Sobs指数、Shannon指数、ACE指数和Chao1指数高于对照组和试验Ⅰ组,但差异均未达到显著水平(P>0.05)。
对粪便样品进行beta多样性分析(图1),基于Bray-Curts算法的主坐标分析(principalco-ordinatesanalysis,PCoA)显示,在操作分类单元(operationaltaxonomicunit,OTU)水平上,大多数样本与同一组的其他样本聚在一起,经相似性分析(analysisofsimilarities,ANOSIM),P值为0.056,说明组间菌群结构变化未达到显著水平(P>0.05);用偏最小二乘法判别分析(partialleastsquaresdiscriminantanalysis,PLS-DA)对样本分组,各组样本分别聚在一起,组间可以区分。

C为对照组,E1为试验Ⅰ组,E2为试验Ⅱ组。下图同。PC1为第1主成分,PC2为第2主成分;COMP1为第1主成分解释度,COMP2为第2主成分解释度。
由图2和图3可知,3组育肥猪粪便样品中注释到的细菌有16个门、25个纲、55个目、93个科、223个属和437个种。在门水平上,厚壁菌门(Firmicutes,87.96%)、拟杆菌门(Bacteroidota,7.19%)和螺旋体门(Spirochaetota,3.30%)的相对丰度较高;在科水平上,梭菌科(Clostridiaceae,32.34%)、链球菌科(Streptococcaceae,15.06%)和消化链球菌科(Peptostreptococcaceae,9.39%)的相对丰度较高;在属水平上,狭义梭菌属1(Clostridium_sensu_stricto_1,32.28%)、链球菌属(Streptocossus,23.00%)和Terrisporobacter(9.10%)的相对丰度较高。
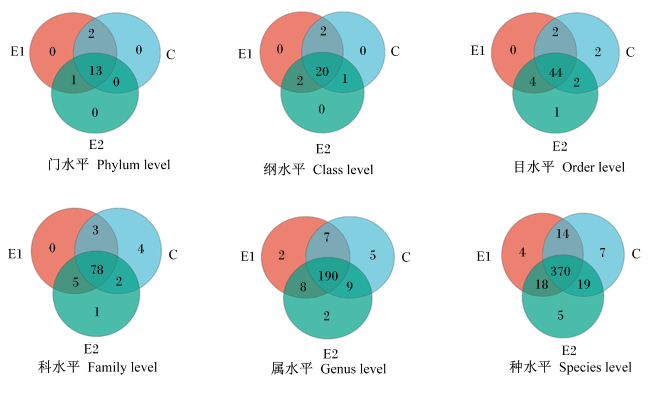
图2粪便菌群门水平至种水平维恩图
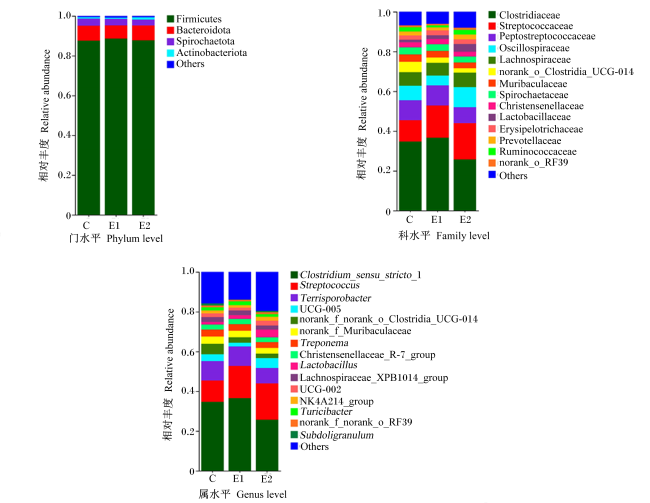
由表4可知,与对照组相比,试验Ⅰ组粪便中颤螺菌目、毛螺菌目、毛螺菌科、瘤胃球菌科、UCG-005、粪杆菌属、小杆菌属和福涅氏菌属的相对丰度显著降低(P<0.05),乳杆菌目和解纤维素菌属的相对丰度显著增加(P<0.05);试验Ⅱ组粪便中毛螺菌目、乳杆菌目和毛螺菌科的相对丰度显著增加(P<0.05)。与试验Ⅰ组相比,试验Ⅱ组粪便中解纤维素菌属的相对丰度显著降低(P<0.05),而颤螺菌目、毛螺菌目、乳杆菌目、颤螺菌科、毛螺菌科、瘤胃球菌科、UCG-005、粪杆菌属、小杆菌属和福涅氏菌属的相对丰度显著增加(P<0.05)。

由表5可知,从3组育肥猪粪便样品中共鉴定出代谢物1054种,其中正离子代谢物660种,负离子代谢物394种;注释到KEGG数据库的代谢物308种,其中正离子代谢物174种,负离子代谢物134种。

图4为3组育肥猪粪便样品间差异代谢物情况的火山图,每个点代表1种代谢物。试验Ⅰ组与对照组粪便样品之间发现9种差异代谢物,其中2种表达上调、7种表达下调;试验Ⅱ组与对照组粪便样品之间发现37种差异代谢物,其中15种表达上调、22种表达下调;试验Ⅰ组与试验Ⅱ组粪便样品之间发现41种差异代谢物,其中24种表达上调、17种表达下调。
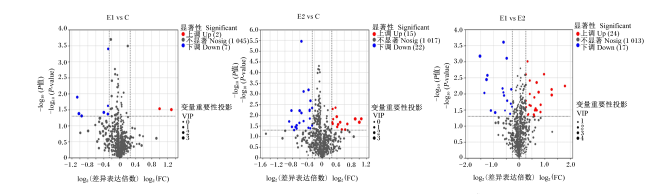
图5为不同组间差异代谢物的KEGG通路富集情况,共发现27条富集通路(P<0.05)。试验Ⅰ组与对照组有3条,分别为托烷、哌啶和吡啶生物碱的生物合成,鸟氨酸、赖氨酸和烟酸生物碱的生物合成,苯丙氨酸代谢。试验Ⅱ组与对照组有13条,分别为谷胱甘肽代谢,β-丙氨酸代谢,新生霉素生物合成,化学致癌-受体活化,cAMP信号通路,铁载体类非核糖体肽的生物合成,肾素分泌,脂肪细胞脂解的调节,阿米巴病,心肌细胞中的肾上腺素能信号传导,利什曼病,色氨酸代谢,系统性红斑狼疮。试验Ⅰ组与试验Ⅱ组有11条,分别为精氨酸生物合成,氮代谢,近端小管碳酸氢盐回收,甲状旁腺激素的合成、分泌和作用,肺结核,γ-氨基丁酸(γ-aminobutyricacid,GABA)能突触,谷氨酸能突触,内分泌和其他因素调节钙的再吸收,色氨酸代谢,抗坏血酸和醛酸代谢,矿物吸收。这些通路的第1层级为代谢、生物体系统和人类疾病等,第2层级主要是氨基酸代谢、其他氨基酸的代谢、能量代谢、碳水化合物代谢、其他次生代谢物的生物合成、萜类和多酮类代谢,还涉及神经、内分泌、消化、排泄、循环等系统以及免疫疾病。
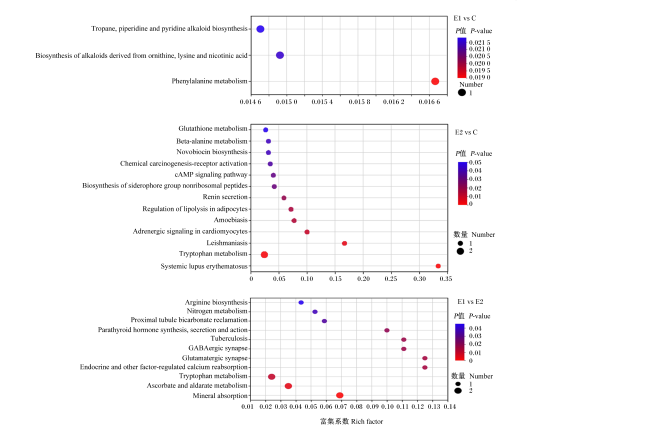
横坐标为富集系数;纵坐标为KEGG通路。图中气泡的大小代表该通路中富集到代谢集中的化合物的数量,气泡的颜色表示不同富集显著性P值的大小。Tropane,piperidineandpyridinealkaloidbiosynthesis:托烷、哌啶和吡啶生物碱的生物合成;Biosynthesisofalkaloidsderivedfromornithine,lysineandnicotinicacid:鸟氨酸、赖氨酸和烟酸生物碱的生物合成;Phenylalaninemetabolism:苯丙氨酸代谢;Glutathionemetabolism:谷胱甘肽代谢;Beta-alaninemetabolism:β-丙氨酸代谢;Novobiocinbiosynthesis:新生霉素生物合成;Chemicalcarcinogenesis-receptoractivation:化学致癌-受体活化;cAMPsignalingpathway:cAMP信号通路;Biosynthesisofsiderophoregroupnonribosomalpeptides:铁载体类非核糖体肽的生物合成;Reninsecretion:肾素分泌;Regulationoflipolysisinadipocytes:脂肪细胞脂解的调节;Amoebiasis:阿米巴病;Adrenergicsignalingincardiomyocytes:心肌细胞中的肾上腺素能信号传导;Leishmaniasis:利什曼病;Tryptophanmetabolism:色氨酸代谢;Systemiclupuserythematosus:系统性红斑狼疮;Argininebiosynthesis:精氨酸生物合成;Nitrogenmetabolism:氮代谢;Proximaltubulebicarbonatereclamation:近端小管碳酸氢盐回收;Parathyroidhormonesynthesis,secretionandaction:甲状旁腺激素的合成、分泌和作用;Tuberculosis:肺结核;GABAergicsynapse:GABA能突触;Glutamatergicsynapse:谷氨酸能突触;Endocrineandotherfactor-regulatedcalciumreabsorption:内分泌和其他因素调节钙的再吸收;Tryptophanmetabolism:色氨酸代谢;Ascorbateandaldaratemetabolism:抗坏血酸和醛酸代谢;Mineralabsorption:矿物吸收。
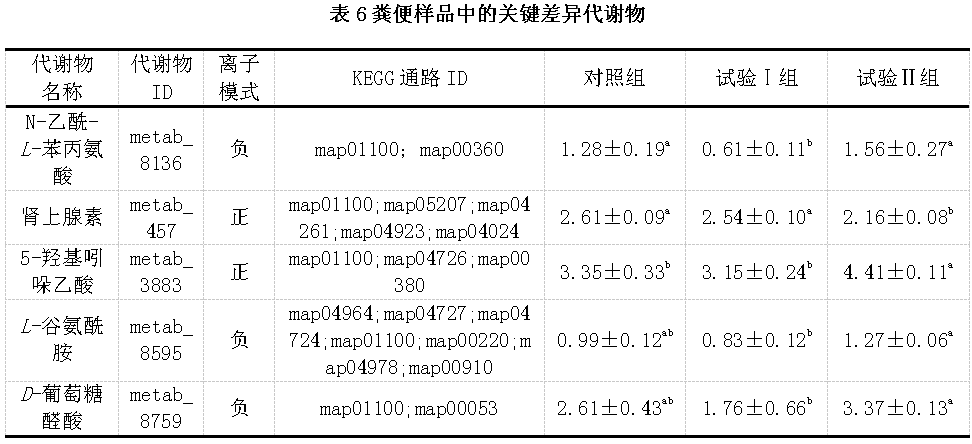
通过对KEGG富集通路进一步分析,发现与通路相关的关键差异代谢物有5种,分别为N-乙酰-L-苯丙氨酸、肾上腺素、5-羟基吲哚乙酸、L-谷氨酰胺和D-葡萄糖醛酸,见表6。与对照组和试验Ⅱ组相比,试验Ⅰ组粪便中N-乙酰-L-苯丙氨酸的表达量显著下调(P<0.05);与对照组和试验Ⅰ组相比,试验Ⅱ组粪便中5-羟基吲哚乙酸的表达量显著上调(P<0.05),肾上腺素的表达量显著下调(P<0.05);另外,试验Ⅱ组粪便中L-谷氨酰胺、D-葡萄糖醛酸的表达量比试验Ⅰ组显著上调(P<0.05)。同时,从表6中还发现肾上腺素、5-羟基吲哚乙酸和L-谷氨酰胺等代谢产物同时参与了多条代谢通路,表明这些代谢产物对代谢通路具有较大的影响。
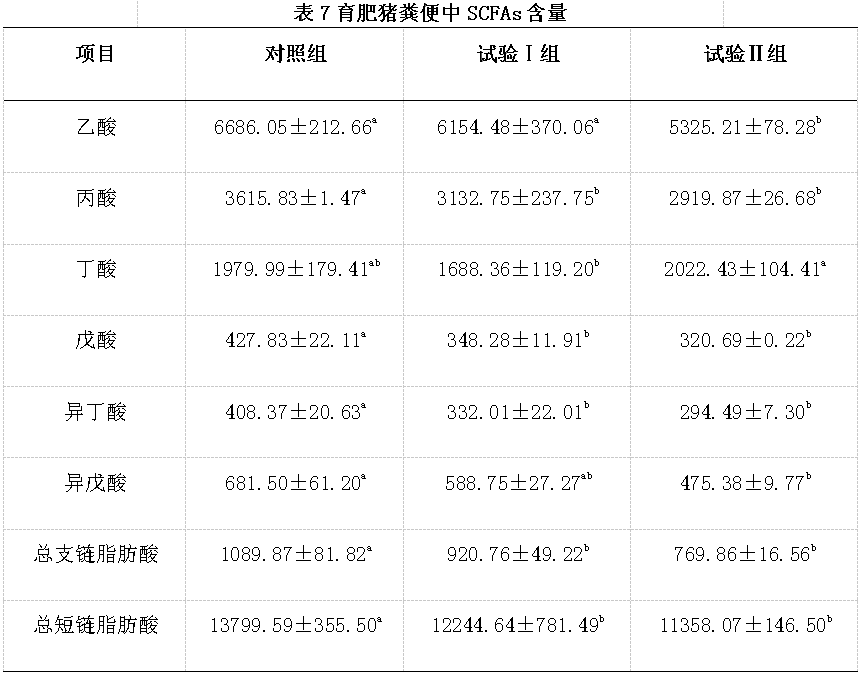
由表7可知,与对照组相比,试验Ⅰ组猪粪便中丙酸、戊酸、异丁酸、总BCFAs和总SCFAs含量显著减少(P<0.05);试验Ⅱ组猪粪便中丁酸含量增加,但未达到显著水平(P>0.05),其他各种SCFAs以及总BCFAs和总SCFAs含量均显著减少(P<0.05)。与试验Ⅰ组相比,试验Ⅱ组猪粪便中乙酸含量显著减少(P<0.05),丁酸含量显著增加(P<0.05)。
由表8可知,试验Ⅰ组和试验Ⅱ组猪粪便中吲哚含量与对照组相比无显著差异(P>0.05),而粪臭素、氨氮含量与对照组相比则显著降低(P<0.05),且以试验Ⅱ组的降幅更大。

3 讨论
已有研究显示,适当降低饲粮中蛋白质水平并补充合成氨基酸不会降低猪的生长性能。马倩倩将饲粮蛋白质水平降低2.5个百分点,并补充赖氨酸、蛋氨酸、苏氨酸、色氨酸、缬氨酸和异亮氨酸等氨基酸,结果显示对育肥猪的平均日增重、平均日采食量和料重比未产生显著影响。本试验将饲粮蛋白质水平降低2个百分点,同时补充赖氨酸、蛋氨酸、苏氨酸和色氨酸,饲喂80~120kg体重阶段的育肥猪,其平均日增重、平均日采食量和料重比与对照组无显著差异,该结果与马倩倩的研究结果一致。而崔家军等将饲粮蛋白质水平降低3个百分点,并补充赖氨酸、蛋氨酸、苏氨酸和色氨酸等氨基酸,结果却发现降低了64~120kg育肥猪的平均日增重和平均日采食量,降低了粗蛋白质、钙和磷的消化率,影响了育肥猪生长性能。还有研究表明,饲粮蛋白质水平过低时,会对猪肠道组织屏障和菌群结构不利,是造成生长性能降低的主要原因。
益生菌可提高饲粮中营养物质的转化率,促进动物生长。王四新等在正常蛋白质水平饲粮中添加复合益生菌(干酪乳杆菌和酿酒酵母)饲喂育肥猪,发现猪的平均日增重显著提高,料重比显著下降,并且饲粮中粗蛋白质、钙和总磷的表观消化率得到提高。García等开展了低蛋白质饲粮和益生菌饲喂仔猪试验,与高蛋白质饲粮(粗蛋白质含量为19.9%)相比,低蛋白质饲粮(粗蛋白质含量为16.1%)中添加益生菌(枯草芽孢杆菌和地衣芽孢杆菌)显著提高了断奶仔猪的平均日增重、平均日采食量,显著降低了料重比。本研究结果显示,在低蛋白质饲粮(粗蛋白质含量为12.35%)中添加益生菌(乳酸菌和酿酒酵母)显著提高了育肥猪的平均日增重,显著降低了料重比,与王四新等和García等的研究结果类似。分析原因,可能是添加益生菌起到了积极作用。乳酸菌能定植于肠道内,产生有机酸、细菌素和过氧化氢等多种代谢产物,这些物质可以减少肠道中致病菌数量,降低肠道疾病发生率,促进肠道健康,提高营养物质消化吸收率和动物生长性能;酿酒酵母自身含有蛋白质、核苷酸、B族维生素、矿物元素和多种酶,通过发酵,可将饲粮中的蛋白质、淀粉、纤维素等大分子物质降解为易消化吸收的小分子物质,其细胞壁中含有β-葡聚糖和甘露寡糖等多糖,能够促进肠道发育,调节肠道菌群结构,提高动物的免疫力和生长性能。因此,在低蛋白质饲粮中添加乳酸菌和酵母菌,会优化肠道菌群结构,提高肠道消化吸收能力,未被消化吸收的营养物质在益生菌作用下被进一步消化吸收,进而提高了育肥猪的饲料转化效率和增重速度。
本研究对3组育肥猪粪便菌群进行了分析,发现均以厚壁菌门和拟杆菌门为优势菌门,狭义梭菌属1、链球菌属和Terrisporobacter为优势菌属,与王四新等和刘辉等的研究结果类似。Zhou等和赵玉梅的研究发现,饲喂低蛋白质饲粮未能影响育肥猪结肠食糜中的微生物多样性。本研究通过对育肥猪粪便菌群进行alpha多样性和beta多样性分析,发现低蛋白质饲粮或低蛋白质饲粮中添加益生菌对育肥猪粪便菌群多样性的影响不显著,说明育肥猪的肠道优势菌群总体稳定,有利于猪群健康和生长性能提高,但同时发现有些菌群的相对丰度会发生改变。马倩倩将饲粮蛋白质水平降低2.5个百分点,发现育肥猪粪便中乳杆菌科的相对丰度显著升高,消化链球菌科、颤螺旋菌科和毛螺菌科的相对丰度显著降低。Zhou等将饲粮蛋白质水平降低3个百分点,发现育肥猪盲肠中乳杆菌属和结肠中链球菌属的相对丰度减少。王四新等研究发现,在正常蛋白质饲粮(粗蛋白质含量为14.11%)中添加益生菌(乳酸菌和酵母菌)对育肥猪粪便中高丰度菌群(如厚壁菌门、拟杆菌门)的影响不显著,而对一些低丰度菌群(如普氏菌属、未标记颤螺菌科等)的影响显著。本研究结果显示,低蛋白质饲粮组(蛋白质水平降低2个百分点)育肥猪粪便中颤螺菌目、毛螺菌目、毛螺菌科、瘤胃球菌科、UCG-005和粪杆菌属等的相对丰度显著低于对照组和低蛋白质饲粮添加益生菌组,解纤维素菌属的相对丰度显著高于这2个组,而且低蛋白质饲粮添加益生菌组育肥猪粪便中毛螺菌目、乳杆菌目和毛螺菌科的相对丰度还显著高于对照组。解纤维素菌属是一类能产生纤维分解酶的细菌,其相对丰度升高预示降解纤维素的能力提升。低蛋白质饲粮中玉米和麦麸比例增加,豆粕比例降低,进入肠道中的蛋白质、淀粉及纤维类物质发生改变,引起菌群变化,当乳酸菌和酵母菌进入肠道后,通过占位、争夺营养、产生代谢产物促进了这些菌群生长,特别是毛螺菌目、乳杆菌目、毛螺菌科和粪杆菌属相对丰度的增加,可能对提高饲料转化效率有益,其作用机理尚需深入研究。
粪便代谢组特征可以反映肠道营养物质在微生物作用下的消化吸收及代谢情况。Zhou等研究表明,降低饲粮蛋白质水平影响氨基酸代谢,包括苯丙氨酸、甘氨酸、丝氨酸、苏氨酸、丙氨酸、天冬氨酸和谷氨酸代谢等。本研究发现,饲喂低蛋白质饲粮育肥猪粪便中N-乙酰-L-苯丙氨酸的表达量显著下调。N-乙酰-L-苯丙氨酸是苯丙氨酸的代谢产物,苯丙氨酸是必需氨基酸,主要参与体内的糖代谢和脂肪代谢。在低蛋白质饲粮中添加益生菌后,育肥猪粪便中5-羟基吲哚乙酸的表达量显著上调,肾上腺素表达量显著下调。5-羟基吲哚乙酸是5-羟色胺(5-hydroxytryptamine,5-HT)的代谢产物,5-HT又称血清素(serotonin),是肠-脑轴的一种关键神经递质,其前体物质是色氨酸。肾上腺素是一种激素和神经传送体,可使机体兴奋性提高,使呼吸加快、心跳加速、血压上升、血液循环加快,促进肝糖原和脂质分解,增加血液中葡萄糖和脂肪酸含量,提高基础代谢率。Gao等的报道指出,给仔猪盲肠灌注淀粉可增加后肠段碳水化合物的利用率,可减少芳香族氨基酸代谢,促进下丘脑神经递质合成。乳酸菌发酵可产生5-HT、GABA等物质,这些物质生理功能广泛,具有镇静、抗惊厥、抗应激等作用,这可能是在低蛋白质饲粮中添加益生菌后育肥猪粪便中5-羟基吲哚乙酸表达量升高和肾上腺素表达量降低的原因。低蛋白质饲粮中添加益生菌后,育肥猪粪便中L-谷氨酰胺、D-葡萄糖醛酸的表达量显著上调。谷氨酰胺是合成氨基酸、蛋白质的前体物质,可有效增强肠道细胞活性,维护肠道功能,促进肠道健康。D-葡萄糖醛酸可作为中间物质合成葡醛内酯、透明质酸和坏血酸等,能与多种有毒物质反应生成无毒的盐类、酯类及相关配合物排出体外,对机体健康有积极意义。
SCFAs是肠道菌群发酵的主要代谢产物。段格艳等和Cho等研究表明,低蛋白质饲粮可显著降低育肥猪结肠中乙酸、丙酸、丁酸和戊酸以及生长猪粪便中总SCFAs和总BCFAs的含量。本研究结果显示,低蛋白质饲粮可显著降低育肥猪粪便中丙酸、戊酸、异丁酸、总BCFAs和总SCFAs含量,与前人研究结果类似。García等研究发现,低蛋白质饲粮中添加枯草芽孢杆菌和地衣芽孢杆菌改变了仔猪肠道发酵模式,减少了氨和BCFAs含量,增加了乙酸、丙酸和丁酸含量。本研究在低蛋白质饲粮中添加乳酸菌和酿酒酵母,与常规蛋白质饲粮相比,育肥猪粪便中丁酸含量增加,乙酸、丙酸、戊酸、总BCFAs及总SCFAs含量显著减少;与低蛋白质饲粮相比,育肥猪粪便中丁酸含量显著增加,乙酸含量显著减少。上述结果与García等[11]的研究所得结果不尽一致,这可能与添加菌种、发酵模式以及饲粮组成不同等有关。丁酸是肠上皮细胞重要的能量来源,丁酸含量增加有利于猪肠道健康和生长性能提高。
肠道菌群发酵未消化吸收的蛋白质、小肽和氨基酸等产生吲哚、酚类、胺类、氨、BCFAs和SCFAs等多种代谢产物,这些代谢产物有的具有正面效应,有的具有负面效应。吲哚和粪臭素是肠道微生物在厌氧条件下分解色氨酸产生的臭味物质,高含量的粪臭素对机体健康、肉品质和养殖环境均有不良影响。肠道中的氨氮主要来源于氨基酸脱氨基反应,其中部分氨氮在肠道被细菌利用合成菌体蛋白,另一部分则通过肠肝循环在肝脏中生成尿素。有研究表明,降低猪饲粮蛋白质水平,减少氮的供给,肠道中代谢氨基酸的菌群活性减弱,粪便中吲哚乙酸、粪臭素和氨氮等臭味代谢物含量会显著降低[5]。本研究证明,低蛋白质饲粮或者低蛋白质添加益生菌饲粮可使育肥猪粪便中粪臭素、氨氮的含量显著降低,与前人的研究结果相似。胡彩虹等研究发现,pH变化影响色氨酸降解为粪臭素和吲哚的相对量,高pH环境下粪臭素的产生量较高,低pH环境下吲哚的产生量较高。粪臭素的嗅阈值较低,臭味比吲哚的更大。盛清凯等证明,使用益生菌发酵饲料可以显著降低猪粪便中粪臭素含量,因为饲料在发酵过程中产生大量有机酸,降低了肠道环境pH,抑制了肠道内粪臭素形成。由此可见,在饲粮中添加益生菌,既可促进肠道健康、提高生产性能,又能降低粪便中粪臭素和氨氮的生成,有利于改善环境。
4 结论
本试验条件下,在低蛋白质饲粮中适量添加益生菌(乳酸菌和酿酒酵母)可改善育肥猪的肠道菌群结构及其代谢物表达,减少粪便中总SCFAs、氨氮和粪臭素的含量,提高育肥猪的平均日增重和饲料转化效率。
参考文献:略。










